Rákbiológiai kutatás
Miért fontos a rákbiológiai kutatás a betegség előrehaladásával szemben?
A rák biológiájának kutatása a legegyszerűbb kérdésekkel kezdődik: Mi az – és nem normális?
A rák kialakulásának és fejlődésének megértése érdekében a kutatóknak először meg kell vizsgálniuk a normális sejtek és a rákos sejtek közötti biológiai különbségeket. Ez a munka azokra a mechanizmusokra összpontosít, amelyek az alapvető folyamatok alapját képezik, mint például a sejtnövekedés, a normál sejtek rákos sejtekké történő átalakulása, valamint a rákos sejtek terjedése vagy metasztázisa.
Az ilyen vizsgálatokból nyert ismeretek elmélyítik a rák megértését, és betekintést nyújtanak, ami új klinikai beavatkozások kialakulásához vezethet. Például a normál sejtekben és a rákos sejtekben a sejtek jelátviteli útjainak vizsgálata nagymértékben hozzájárult a betegséggel kapcsolatos ismereteinkhez, feltárva a molekuláris változásokat, amelyek a különböző típusú rákok között oszlanak meg és a lehetséges kezelési stratégiákat mutatják.
Az elmúlt néhány évtizedben a rákkutatás alapkutatásai széles körű tudásalapot hoztak létre, amely kritikus volt a betegség előrehaladásához. Valójában sok előrelépés történt a rák megelőzésében, diagnosztizálásában és kezelésében, nem lett volna olyan tudás nélkül, amely a rák biológiájával kapcsolatos alapvető kérdéseket vizsgálta.
Lehetőségek a rákbiológiai kutatásban
A tudósok ma egyre jobban megértik a különféle mutációk által kiváltott rákos megbetegedések biológiáját és számos testhelyzetet. Az új adatok és kutatási módszerek lehetőséget teremtettek a kutatók számára, hogy részletesen tanulmányozzák a rákbiológia számos aspektusát, beleértve azt is, hogy a sejtproliferáció és a halál normális biológiai programjai miként változtak a rák alatt, és hogy az immunrendszer hogyan reagál a daganatokra.
A tumoros őssejtek felfedezése számos rákban lehetővé tette a kutatók számára, hogy azonosítsák ezeket a ritka sejteket mind a szolid tumorokban, mind a hematológiai rákokban, valamint hogy vizsgálják meg e sejtek szerepét a betegség különböző szakaszaiban.
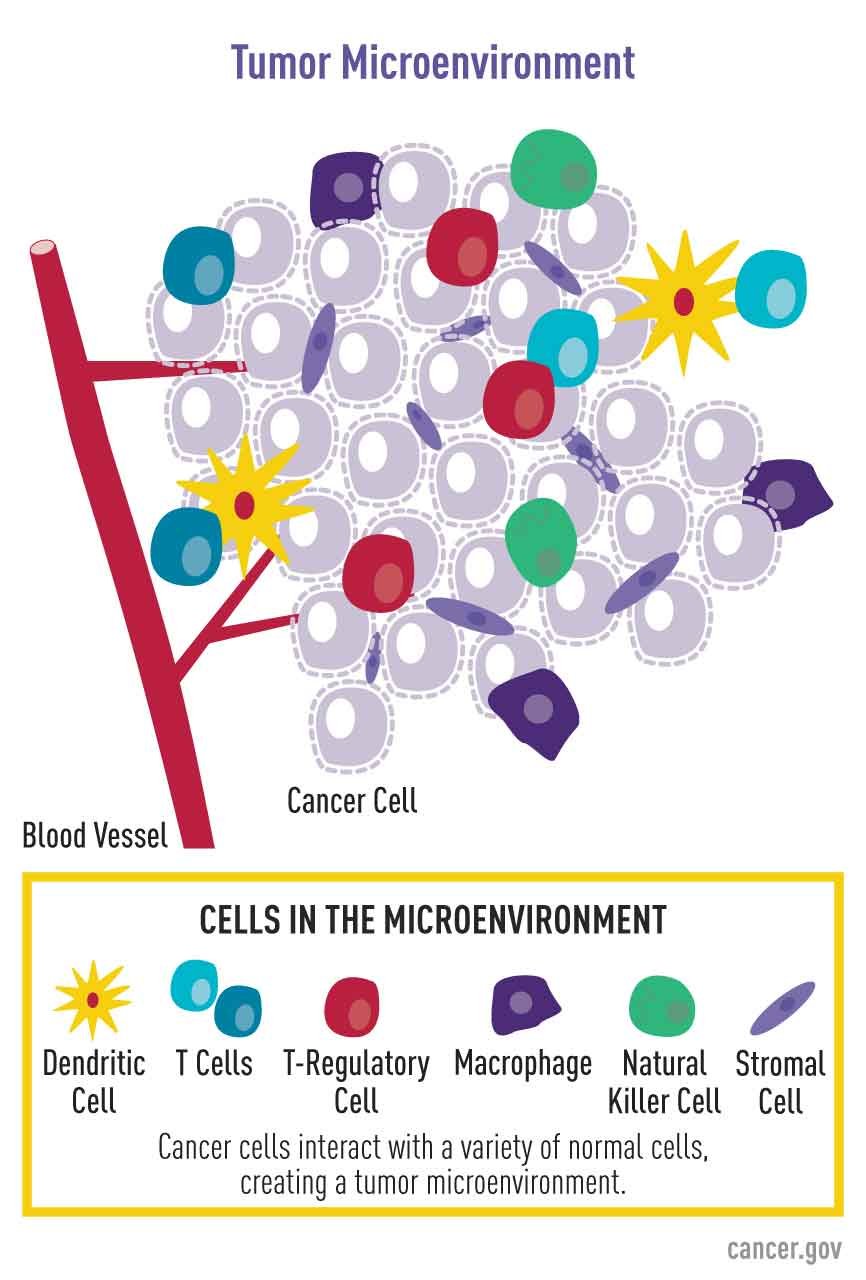
Az a felismerés, hogy a rákos sejt szimbiotikus kapcsolatban van a tumormikroképpel, lehetőséget teremtett arra, hogy tanulmányozza a rákos sejtek közötti kölcsönhatásokat a daganatban vagy a gazda mikrokörnyezetében. A kutatók most tanulmányozzák a ráksejtek fejlődésének, proliferációjának és metasztázisának molekuláris mechanizmusait és jelátviteli útjait.
Az egyre növekvő érdeklődés a mikrobiómában, az emberi testben élő mikroorganizmusok és vírusok közösségében arra késztette a kutatókat, hogy vizsgálják meg az emberi mikrobiológia szerepét a tumorok beindításában és progressziójában.
Az elmúlt évtizedben kifejlesztett új genetikai technológiák segítették a kutatókat megvizsgálni a rák kialakulásának alapját képező genetikai változások funkcionális hatásait. Ezeket az eszközöket arra is felhasználták, hogy tanulmányozzák a rákkal összefüggő epigenetikus változásokat, a DNS károsodásának és javításának mechanizmusát és a génszabályozást a rákos sejtekben.
Az egyre erősebb szerkezeti biológiai megközelítések bevezetése lehetővé tette a kutatók számára, hogy részletesebben részletezzék a rákban érintett mutáns fehérjék szerkezetét, mint például a RAS-t és más molekulákat. Az egész proteom jellemzését lehetővé tevő megközelítéseken keresztül a kutatók integrálják a genomikai analízist a fehérjék tumorsejtekben történő elemzésével, hogy részletesen megtanulják, hogyan befolyásolják a rákkal kapcsolatos mutáns fehérjék más fehérjéket.
Proteogenomika kutatás: a precíziós orvoslás határán
Különben a genomika és a proteomika részleges képet nyújt a rák-biológiáról. A proteogenomikával végzett kutatások együttesen egységes képet nyújtanak a rákról. A kutatók reménykednek abban, hogy a proteogenomika, a proteomika és a genomika integrált vizsgálata javíthatja a rák megelőzésére, diagnosztizálására és kezelésére a molekuláris szinten precíziós gyógyszer segítségével.
Lehetőség van arra is, hogy a rendszerbiológiai megközelítések révén feltárják a rákos biológiát. A kutatók számos információt és eszközt használnak, például a matematikai modellezést, hogy leírják a biológiai rendszer összetevőinek összetett kölcsönhatásait, és olyan előrejelzéseket tesznek lehetővé, amelyek segítenek a kísérleti tudomány irányításában és tovább finomításában.
Kihívások a rákbiológiai kutatásban
A rákkutatás alapkutatását gyakran "nagy kockázatnak" tekintik, részben azért, mert egy adott kutatási projekt klinikai alkalmazása nem feltétlenül lehet kezdettől fogva tisztázni. A ráksejt-biológia tanulmányozásából nyert ismeretek azonban nemcsak javítják a betegség megértését, hanem elengedhetetlenek a betegek számára előnyös klinikai fejlődéshez, mivel az immunterápia és a rákos vakcinák területén tapasztalt újabb fejleményt szemléltetik.
Mindazonáltal a rákellenes alapkutatás eredményeinek bizonytalansága miatt ez a kutatási terület viszonylag kevés forrást kap a nyereség által támasztott forrásokból. Emiatt kritikus a szövetségi finanszírozás a rákbiológiai kutatáshoz.
A tudományágak közötti együttműködés egyre inkább szükséges ahhoz, hogy jobban megértsük a legfontosabb mechanizmusokat a rákban. Ezért egyes kutatóknak szükségük lehet arra, hogy dolgozzanak ki eszközöket és stratégiákat a kutatási eredmények megosztására és kommunikálására.
Az NCI szerepe a rákbiológiai kutatásban
Az NCI támogatja és irányítja a normál sejtek és a ráksejtek közötti biológiai különbségek kutatását számos programon és megközelítésen keresztül. A Rákbiológiai Osztály (DCB) például olyan extramurális kutatókat támogat, akik különböző módszereket alkalmaznak a rákbiológia tanulmányozására.
A fent említett témák közül sokban a DCB támogatja a következőket:
- a rákos sejtek anyagcseréjét, a rákos sejtek stresszre adott válaszát és a sejtciklus szabályozásában részt vevő mechanizmusokat
- biológiai anyagok (például vírusok és baktériumok), gazdaszervezetek (például elhízás, társbetegségek és életkor) és viselkedési formák (például táplálékbevitel), amelyek a rák kialakulásához vagy hozzájárulását okozhatják
- a tumorok kialakulásának és elterjedésének immunrendszere, valamint a rákos sejtek immuncélzásának és megsemmisítésének javítására irányuló megközelítések
- a genomi instabilitás és a kapcsolódó molekuláris, citogenetikai és kromoszomális hatások az indukció folyamán és a rosszindulatú
- a gyulladás által létrehozott mikrokörnyezet és a gyulladásos jelátviteli molekulák szerepe a tumorok kialakulásában és progressziójában
- folyamatok és molekuláris célpontok, ahol lehetőség van terápiás vagy megelőző beavatkozásra
- a hipoxia hatása a tumorsejtek inváziójára és metasztázisaira
- a szomatikus őssejtek szerepe a tumor progressziójának és metasztatikus viselkedésének meghatározásában, valamint az őssejt-résben a tumor mikrokörnyezetének szabályozásával
Az NCI által támogatott kutatási programok a rákbiológiában a következők:
- Az onkológiai hálózat fizikai tudományai (PS-ON)
A kezdeményezés célja a fizikai tudomány és a rákkutatás konvergenciájának előmozdítása és elősegítése. A fizikai tudósok (mérnökök, fizikusok, matematikusok, vegyészek és számítástudósok) és a rákkutatók (rákbiológusok, onkológusok és patológusok) kis transzdiszciplináris csoportjai együttműködnek olyan problémák megoldásában, mint például az agy és a vérképző tumorok sejtjeinek meghatározása és vizsgálják az egyes sejtek háromdimenziós képének mint rákszignatúráknak a használatát. - Rákrendszerek Biológiai Konzorcium (CSBC)
A CSBC arra összpontosít, hogy a fejlett kísérleti megközelítéseket matematikai és számítási módszerekkel ötvözi a rák előrejelző modelleinek felépítésére és tesztelésére. A kezdeményezés integratív megközelítést alkalmaz a rákkutatás terén, hogy kiegészítse és kiterjessze a tumorfejlődés és a progresszió jelenlegi ismereteit számos fizikai és időbeli skálán keresztül, a végső cél a rákbetegek életének javítása. - Barrett’s Esophagus Translational Research Network (BETRNet)
Ez a multidiszciplináris, több intézményes együttműködést azért hozták létre, hogy jobban megértsék a Barrett-esophagot és megakadályozzák a nyelőcső adenokarcinóma kialakulását. A BETRNet célja, hogy jobban megértse a nyelőcső adenokarcinóma (EA) biológiáját; megvizsgálja a prekurzor lézióval kapcsolatos kutatási lehetőségeit, a Barrett-esophágist; javítsa az EA kockázati rétegződését és előrejelzését; és stratégiákat biztosítanak az EA megelőzésére. A legfontosabb cél a rák előfordulása, morbiditása és mortalitásának csökkentése. - A glikobiológusok szövetsége a rák kimutatásához
Ez a tumor glikogik laboratóriumok konzorciuma és kutató partnereik tanulmányozzák a komplex szénhidrátok rákkal kapcsolatos dinamikáját. Ez a program, amelyet az NCI szponzorálja az Országos Általános Orvostudományi Intézet és a Nemzeti Szív, Tüdő- és Vérintézet Intézetében, célja, hogy tanulmányozza a glikánok szerkezetét és működését a rákkal kapcsolatban. - A Screen-Detected Lesions Initiative molekuláris és celluláris jellemzése
A program célja, hogy átfogó molekuláris és celluláris jellemzést végezzen a tumorszövet, a sejtek és a mikrokörnyezet összetevői között, hogy meg lehessen különböztetni a képernyő által kimutatott korai elváltozásokat az intervallumtól és a tünetekkel detektált rákoktól. A kutatók különböző technológiákat és megközelítéseket alkalmaznak a korai léziók sejtes és molekuláris fenotípusainak meghatározására, a korai elváltozások sorsának jobb megjósolására. - Klinikai Proteomikus Tumorelemző Konzorcium (CPTAC)
A CPTAC-t az NCI Rákkutató Klinikai Proteomikai Kutatási Hivatala (OCCPR) indította el, hogy szisztematikusan azonosítsa a rákos sejtek genetikai változásaiból eredő fehérjéket, tanulmányozza, hogyan hatnak a biológiai folyamatokra, és ezeket az adatokat kísérő vizsgálatokkal és protokollokkal látják el a nyilvánosság számára. - Az Applied Proteogenomics OrganizationaL Learning and Outcomes Network (APOLLO)
A Department of Defense (DoD), a Veteránügyi Hivatal (Department of Veterans Affairs, VA) és az NCI közötti együttmûködés a legutolsó genomiális és proteomikai kutatási módszerek segítségével gyorsabb és pontosabb azonosítás céljából a páciens tumorának proteogén profilján alapuló, rák kezelésére szolgáló hatékony gyógyszerek számára. A kezdeti együttműködési erőfeszítések középpontjában 8000, tüdőrákos beteg tartozik, és az adatokat széles körben hozzáférhetővé teszik a kutatói közösség számára. Végül az erőfeszítéseket további rák típusokra bővítik.
Az NCI kiválósági központjai az NCI Rákkutató Központja és a Rák Epidemiológiai és Genetikai Részlegének intramurális kutatóit hozják létre új projektek és kezdeményezések kidolgozására a rák-biológia különböző területein, többek között:
- Kromoszóma biológia
A központhoz tartozó szakértők a kromoszómafunkcióval kapcsolatos mechanizmusokat tanulmányozzák különböző kutatások révén, amelyek magukban foglalják a genom és a transzkriptum dinamikus változásait a rák kialakulásának és a rák korai diagnózisának transzlációs kutatásai során. - Integratív rákbiológia és genomika
A központ célja, hogy fejlett analitikus technológiákat használjon a betegek homogén csoportjainak meghatározására, akiket megfelelő terápiákkal kezelhet. A kutatók ebben a központban a rendelkezésre álló alapvető kutatási adatokra támaszkodnak, amelyek célja a felfedezés és a betegek előnyeinek rövidítése öt különböző területen: biomarkerek és molekuláris célok, genomikus megközelítések, emberi genomika és genetika, rákos gyulladás , és integratív / rendszerbiológia és bioinformatika.
Szemináriumok a rákbiológiában
Adja meg bejelentkezési adatait alább. Ha még nem rendelkezik fiókkal, itt be kell jelentkeznie.
Szerzői utasítások
Hasznos Linkek
Ellenőrizze a benyújtott papírt
A cikkek benyújtási rendszereinek áttelepítése miatt ellenőrizze a benyújtott kéziratok állapotát a megfelelő rendszerben:
- Ellenőrizze a benyújtott kézirat állapotát az EVISE-ban
Nyomja meg az elfogadott papírt
Miután a cikk létrehozása megkezdődött, nyomon követheti a cikk állapotát az Elfogadott cikk követése segítségével.
- CiteScore: 8,52 ∙ A CiteScore az ebben a címben közzétett dokumentumra kapott átlagos idézéseket méri. A CiteScore értékek egy adott év (például 2015) idézett számláján alapulnak, a három korábbi naptári évben közzétett dokumentumokra (például 2012-14), osztva a három korábbi év (például 2012-14) dokumentumainak számával.
- Bővebben a CiteScore-ról
- Hatásfok: 9,141 ℹ Hatásfok:
2016: 9,141
A Impact Factor az adott év során kapott idézetek átlagos számát a naplóban a két előző év során közzétett papírok alapján határozza meg.
2017 Journal Citation Reports (Clarivate Analytics, 2018) - 5 éves impakt faktor: 9.530 ℹ Ötéves impakt faktor:
2016: 9,530
Az ötéves Impact Factor kiszámításához az idézéseket 2016-ban kell számolni az elmúlt öt évre, és el kell osztani az elmúlt öt évben közzétett forráselemekkel.
2017 Journal Citation Reports (Clarivate Analytics, 2018) - Forrás Normál hatású papírra (SNIP): 2.008 ℹ Forrás Normál hatású papírra (SNIP):
2016: 2,008
A SNIP a kontextus szerinti idézet hatását a hivatkozott témákban szereplő összes hivatkozás alapján a hivatkozások súlyozásával határozza meg. - SCImago Journal Rank (SJR): 4,528 ℹ SCImago Journal Rank (SJR):
2016: 4,528
Az SJR egy presztízs metrika, amely azon az elképzelésen alapul, hogy nem minden idézet azonos. Az SJR hasonló algoritmust használ, mint a Google Page Rank; ez kvantitatív és minőségi mércét biztosít a folyóirat hatásának.
- Szerző statisztika ℹfoglalása Szerző statisztikái:
A cikk közzététele velünk számos előnnyel jár, például a személyes irányítópulthoz való hozzáféréshez: az Ön publikációira vonatkozó idézet és használati adatok egy helyen. Ez az ingyenes szolgáltatás mindenki számára elérhető, akinek közzététele a Scopusban található. - Kutató Akadémia
- Szerzői szolgáltatások
- Próbálja ki a személyre szabott figyelmeztető funkciókat
Szemináriumok a rákbiológiában egy revíziós folyóirat, melynek célja a tudósok tájékoztatása a fejlesztés területén molekuláris onkológia egy téma alapján. Mindegyik kérdés tematikus megközelítés, amely egy fontos érdeklődésre törekvő téma rákos biológusok, az alapul szolgáló genetikai és molekuláris molekulákból.
Szemináriumok a rákbiológiában egy revíziós folyóirat, melynek célja a tudósok tájékoztatása a fejlesztés területén molekuláris onkológia egy téma alapján. Mindegyik kérdés tematikus megközelítés, amely egy fontos érdeklődésre törekvő téma rákos biológusok, a mögöttes genetikai és molekuláris okokból sejtes transzformáció és a rák a potenciál molekuláris alapjára terápiák. Minden kiadást egy vendégszerkesztő vagy szerkesztők szerkesztenek, egy nemzetközileg elismert szakértő (k) a területen, és mintegy nyolc-tizenkét tekintélyes meghívott véleményt tartalmaz a tématerület különböző aspektusairól. Az egyes témák célja, hogy összehangolt, olvasható és élénk áttekintést nyújtsanak egy kiválasztott területről, amelyet gyorsan közzétettek a valuta biztosítása érdekében.
A következő témakörökben tárgyalt témák a következők:
• A glikáció szerepe a különböző típusú rákokban
• Immuno-onkológiai biomarkerek
• Epigenetika: szilárd tumorok és hematológiai rosszindulatú betegségek
• Jelenlegi jövőkép a céimenzimekről a rákterápiára
• transzlációs rák genomikája
• FOXO család a rákban
• A biomarker felfedezésben megjelenő trendek: a prognózis megkönnyítése és a rák előrejelzése
• Néhány piszkos Ras páncélban: az új rákterápiák a horizonton
• Konferencia – Rákos őssejtek: hatás a kezelésre
Ha javaslatot vagy ötletet szeretne kapni egy tematikus kérdéshez, kérjük, töltse ki a tematikus pályázati űrlapot, és küldje el a szerkesztőségnek (Ms. Carly Middendorp, c.middendorp@elsevier.com).
Előnyök a szerzőknek
Számos szerzõi elõnyt is biztosítunk, például ingyenes PDF-t, liberális szerzői jogi szabályozást, speciális engedményeket az Elsevier kiadványokra és még sok mást. Kérjük, kattintson ide további információkért szerzői szolgáltatásainkról.
Tekintse meg a cikkek benyújtásával kapcsolatos útmutatót a szerzők számára. Ha további információra vagy segítségre van szüksége, kérjük, keresse fel a Support Center-t.
Rákbiológia
Ismerje meg, hogyan gyógyítunk betegeket a tudományon keresztül együttérzés
Kutatási erőforrások
Szakmai képzés
Kutatási hírek
Az öregedő idegi őssejtek fehérjecsomóinak felszámolása fokozza tevékenységüket
Fedezze fel a kutatásokat
Ismerje meg, hogyan tápláljuk az innovációt
Oktatási források
Oktatási hírek
És a borítékot kérjük: A diplomás diákok a rezidenciákhoz illeszkednek
Fedezze fel az oktatást
Ismerje meg, hogyan erősítjük a holnap vezetõit
Támogassa a Stanford Medicine-ot
Támogassa a gyermekek egészségét
A Rákbiológiai Program igazgatói
Laura Attardi
A sugár-onkológiai és genetikai osztályok
Julien Sage
Gyermekgyógyászati és genetikai osztályok
Üdvözöljük 2018-19 Rákbiológia PhD Program osztály
Program Hírek
Howard Chang bejelentette Howard Hughes Orvosi Intézet kutatója
Howard Chang MD, PhD, a bőrgyógyászat professzora az új Howard Hughes Orvostudományi Intézet egyik kutatója.
2017-es osztály
PhD Lab Coat Ceremony
Howard Chang az Országos Orvosi Akadémiára választott
Howard Chang, MD, PhD, a bőrgyógyászat professzora, megválasztották az Országos Akadémia Akadémiájába.
2017 STAT Wunderkind
Daniel E. Webster alumnus, Ph.D., "2017 STAT Wunderkind" -ként ismertté vált. Dr. Paul Khavari Lab-ban dolgozott, jelenleg Damon Runyon Fellow a Nemzeti Rákkutató Intézetben, ahol Dr. Louis Staudt dolgozik a B-sejtes lymphoma genomikáján.
A Landers, Doudnas és a világ bradnerei rengeteg címet kapnak. Ezért elindultunk, hogy megtaláljuk a tudományos szupersztárok következő generációját. Az elmúlt néhány hónapban a STAT szerkesztők és újságírók csapata közel 300 jelölést kapott Észak-Amerikában. Nem állítottunk be korhatárt; a lenyűgöző orvosokra és kutatókra vadásztak a pályán, de a pályafutásuk kezdetén még nem teljesen függetlenek voltak. Legtöbbjük a posztdoktorok, társaik és biopharma munkatársai voltak, akik több vezető tudósokkal dolgoztak. Minden lángoló új ösvény, mivel megpróbálnak választ adni a legfontosabb orvosi kérdésekre. Ismerje meg a 201-es STAT Wunderkinds-et.
Tanulmány feltárja a mutációt, amely felülírja a tumor-szuppresszort
Laura Attardi, PhD, professzor, Department of Radiation Oncology and Genetics és munkatársai találták a mutációt a p53 tumorszuppresszor fehérjében, amely "szuper" szupresszorrá alakul.
Az egyszeresen telítetlen zsírok segítik a zsiráfokat, hogy tovább éljenek
Anne Brunet és csapata meglepődve állapította meg, hogy azok a pudgyférgek, amelyek többszörösen telítetlen zsírt halmoztak fel testükben, hosszabb élettartamúak voltak, mint a vékonyabb férgek. (Gregg Segal)
A Stanford Medicine kutatói az Országos Rákkutató Intézet kiemelkedő kutatóinak nevezték el
A Nemzeti Rákkutató Intézet az orvostudomány professzora Dr. HOWARD CHANG és az onkológia professzora, RONALD LEVY, az intézet kiemelkedő kutatói díjainak 2016-os címzettjeként nevezte ki.
Forbes 30 alatt 30: Tudomány
Gratulálok hozzá Michelle Atallah (és a PI-jét Ed Engleman és Parag Mallick), akiket a forbes "30 30 év alatti" csúcsán választottak ki.
Tudományos bíró Cigall Kadoch Gerald Crabtree laboratóriumi doktorátus volt.



Kommentek
Kommenteléshez kérlek, jelentkezz be: